Brandstofcel
Brandstofcellen zijn elektrochemische toestellen die chemische energie van een doorgaande reactie direct omzetten in elektrische energie. De chemische energie hoeft dus niet eerst omgezet te worden in thermische energie en mechanische energie, waardoor er nauwelijks verliezen optreden en de brandstofcel op een hele efficiënte manier energie opwekt. In de cel vindt een redoxreactie plaats. In dit opzicht lijkt een brandstofcel op een batterij of accu, toch is er een belangrijk verschil tussen een accu of batterij en een brandstofcel. In een brandstofcel kunnen namelijk steeds opnieuw reagentia (bijvoorbeeld: waterstof en zuurstof) van buitenaf worden aangevoerd, terwijl de reagentia in een batterij of accu opgeslagen zitten in een gesloten stelsel.
De werking
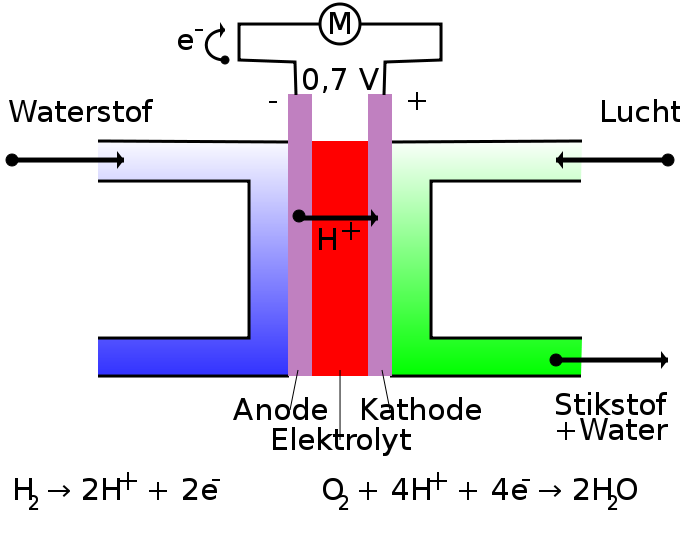
Een brandstofcel bestaat uit een poreuze anode en kathode met daartussen een elektrolytlaag.
Waterstof en zuurstof worden afzonderlijk van elkaar aan de brandstofcel toegevoerd. Het waterstof bij de anode en het zuurstof (oxidator) bij de kathode. In de cel worden deze twee stoffen door een membraan gescheiden. Met behulp van een katalysator wordt het waterstof (H2) aan de anode gesplitst in twee H+-ionen en twee elektronen (e-). De elektronen stromen vervolgens via een elektrisch circuit naar de kathode: dit is de elektrische stroom die gebruikt kan worden om bijvoorbeeld een elektromotor mee aan te drijven. De protonen stromen door de elektrolyt naar de kathode. De protonen en elektronen komen bij de kathode weer samen en reageren daar met het zuurstof (O2) die bij de kathode wordt ingevoerd. Daarbij ontstaat water (H2O). Hieronder staat een overzicht van de chemische reacties die in een brandstofcel plaatsvinden:
- Anode: H2 → 2H+ + 2e-
- Kathode: O2 + 4H+ + 4e- → 2H2O
- Gehele cel: 2H2 + O2 → 2H2O + energie (elektriciteit en warmte)
Een enkele brandstofcel levert in theorie een spanning van ongeveer 1,20 volt, maar in de praktijk ligt die spanning veel lager; tussen de 0,5 en 0,8 volt. Om de spanning te verhogen worden de afzonderlijke cellen op elkaar gestapeld en in serie geschakeld. De stapel die zo ontstaat wordt een "brandstofcelstack" of "stack" genoemd.
Rendement
In brandstofcellen zijn hogere rendementen mogelijk dan in gewone verbrandingsmotoren of stoommachines doordat de energieomzetting niet verloopt volgens de Carnotcyclus. In de Carnotcyclus wordt de chemische energie namelijk eerst in warmte omgezet en pas daarna in bijvoorbeeld elektrische energie:
| Brandstofcel: | Chemische energie | → | Elektrische energie (Arbeid) | ||
|---|---|---|---|---|---|
| Carnotcyclus: | Chemische energie | → | Warmte | → | Elektrische energie (Arbeid) |
Bij de laatste stap treden als gevolg van de tweede hoofdwet van de thermodynamica noodzakelijkerwijs grote verliezen op, doordat altijd maar een deel van de warmte in arbeid kan worden omgezet. Bij brandstofcellen is dit niet het geval. Toch treden er ook in brandstofcellen omzettingsverliezen op; een typische brandstofcel van 0,7 volt heeft een rendement van ca. 50%.
Bouw zelf een brandstofcel.
Fuel Cell Handbook, Seventh Edition.