Zelle, Akku, Batterie 1
Was Sie schon immer darüber wissen wollten
Allein bei den Begriffen Zelle, Akku, Batterie, Sammler geht es im Sprachgebrauch kunterbunt durcheinander. Deshalb hier einige Grundlagen und ein wenig mehr (für die Praxis) über diese Energiespeicher. Teil 1 beschäftigt sich zunächst auch mit Bleisammlern, im zweiten Teil folgen die NC-Sammler, und der dritte Teil vermittelt Kenntnisse über Primärbatterien.
Zunächst einige Anmerkungen zur Begriffsklärung: Eine Batterie besteht aus mehreren Zellen, ist also eine Anordnung aus mindestens zwei galvanischen Zellen, die gemeinsam eine Gesamtstromquelle ergeben. In aller Regel sind diese Zellen in Reihe geschaltet, natürlich um eine entsprechend hohe Spannung zu erreichen. Es ist daher völlig falsch, beispielsweise eine 1,5-V-Mignon-Zelle als Batterie zu bezeichnen, hingegen darf man die 9-V-Blockbatterien durchaus als solche bezeichnen, weil in ihrem Inneren mehrere Zellen in Reihe geschaltet sind (Abb. 1). Bei dieser Namensregelung spielt es keine Rolle, ob es sich um Primär- oder Sekundärzellen handelt.
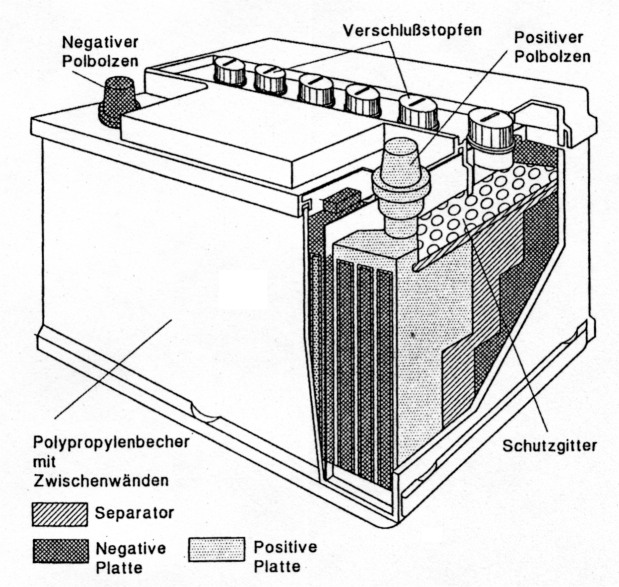
Abb. 1: Eine Batterie besteht aus mehreren Zellen. Hier ein Bleiakkumulator (Starterbatterie) im Schnitt.
Primär- und Sekundärzellen Aber was sind nun wieder Primär- und Sekundärzellen? Die Primärzelle ist ein galvanisches Element, welches durch elektrochemische Reaktionen eine Spannung erzeugt. Diese Reaktion läßt sich praktisch nicht oder nur in unbedeutendem Ausmaß umkehren. Merke: Primärelemente sind nicht zur Wiederladung bestimmt. Ein solcher Versuch kann sogar gefährlich werden, da in der Zelle Gase entstehen können, welche explosiv den Mantel der Zelle sprengen, besonders bei Quecksilberoxid-, Alkali-Mangan- und Silberoxidzellen.
Eine Sekundärzelle darf man ruhig auch als Akkumulator, kurz Akku, oder Sammler bezeichnen. Hier ist die chemische Reaktion umkehrbar, welche die Spannung erzeugt. Man sagt auch, die Reaktion ist reversibel. Leider aber ist sie das in der Praxis nie zu 100 Prozent. Die beim Laden zugeführte elektrische Energie kann man niemals völlig wieder entnehmen, beim Bleiakku sind es rund 83 Prozent. Zudem, ist der Akku erst einmal voll geladen, findet die Umkehrreaktion auch dann in einem gewissen Maße statt, wenn extern überhaupt kein Strom entnommen wird: Selbstentladung! Diese Selbstentladung nimmt mit steigender Temperatur zu.
Will man Akkus längere Zeit lagern, so sollte man beachten, daß die Selbstentladung "gesunder" Akkus durchaus bis etwa 1 Prozent der Kapazität pro Tag betragen kann. Moderne Starterbatterien haben 2,5 Prozent Antimon im Gitterblei, wodurch die Selbstentladerate auf 0,2 Prozent/Tag bei Zimmertemperatur gesenkt werden konnte, hingegen können Batterien für Antriebszwecke durchaus Selbstentladeraten von 2 Prozent/Tag erreichen.
Der Bleiakkumulator, ein Arbeitspferd
Nachdem nun die Begriffe klargestellt sind, kommt jetzt der Bleiakkumulator unter die Lupe, der übrigens schon 1850 von Josef Sinsteden entdeckt, von Gaston Planté verbessert und schließlich 1866 von Werner von Siemens zur Praxisreife entwickelt wurde. Und weil wir gerade bei Geschichtsdaten sind, so sei erwähnt, daß galvanische Zellen schon 250 v.Chr. benutzt wurden, um Silberfiguren zu vergolden. Experten schätzen anhand von Funden vergoldeten Schmuckes, daß bereits 2500 v.Chr. die Erzeugung elektrischen Stroms bekannt war.
Wohl allen Lesern dürfte der Bleiakkumulator in seiner Form als Autobatterie" bekannt sein. Sie merken, den Begriff "Autobatterie" darf man verwenden, denn hier sind sechs Zellen in Reihe geschaltet. Nun dazu ein wenig Chemie, die Sie aber auch ruhig überlesen dürfen. Nur sollten Sie eines wissen: Blei und Bleiverbindungen in Form von Staub, aber auch gelöst, sind stark giftig. Schon kleinste Mengen führen bei Aufnahme in den Körper zu lebensgefährlichen Erkrankungen. Teuflischerweise reichert sich Blei im Körper an. Bitte denken Sie bei zu entsorgenden Akkus an diese Gefahr...
Etwas Chemie
Der Bleiakkumulator besitzt als positive Elektrode eine Bleioxid-Verbindung und als negative reines Blei. Als Elektrolyt dient Schwefelsäure, H2SO4, welche sehr aggressiv ist. Wer schon mal Batteriesäure auf Haut oder Kleidung abbekommen hat, kann dies leicht bestätigen. Eine wichtige Funktion übernimmt der poröse Scheider, welche die Platten vor elektrischer Verbindung schützt. Dieser säurefeste, meist aus Kunststoff bestehende Separator, wie man ihn auch nennt, verhindert auch Bleischlamm-Brücken. Als Kunststoffe dienen Polyvinylchlorid, Polyethylengranulat oder zu Platten gesinterte schwefelsäurefeste Cellulosefasern.
Während der Entladung werden beide Elektroden in Bleisulfat verwandelt, das während der Ladephase in die ursprünglichen Stoffe Blei und Bleioxid zurückverwandelt wird. Bei der Entladung wird je ein Teil positive Masse (Pb02) und negative Masse (Pb) mit Hilfe von zwei Teilen Schwefelsäure (2 H2SO4) in je einen Teil Bleisulfat (PbSO4) an beiden Elektroden umgewandelt, wobei zwei Teile Wasser (2 H20) frei werden. Die sogenannte Säuredichte in der Zelle sinkt durch diese Verdünnung mit Wasser. Diese Verdünnung kann man mit einer Dichtespindel (Areometer) messen und somit den Ladezustand anhand der Dichte bestimmen.
Bei der Ladung verläuft die Geschichte umgekehrt. Das Bleisulfat wird in je einen Teil Blei (Pb) und Bleioxid (Pb02) verwandelt. Es entstehen zwei Teile Schwefelsäure (2 H2SO4), und die Säuredichte steigt dementsprechend wieder. In geringem Maße entsteht auch aus dem Wassern aufgespaltener Wasser- und Sauerstoff, weshalb normale Autobatterien in regelmäßigen Abständen mit entmineralisiertem Wasser aufzufüllen sind.
Vorsicht vor Überladung!
Was hat es aber mit dem "Gasen" von Bleiakkus auf sich? Ganz einfach: Wenn sich die Zelle der Ladeschlußspannung von 2,39 V nähert und das gesamte Bleisulfat in Blei und Bleioxid umgesetzt wurde, spielt sich die uns allen noch aus dem Chemieunterricht bekannte Knallgasreaktion ab, es wird also das Wasser in seine Bestandteile Wasserstoff und Sauerstoff zerlegt. Werden diese beiden gasförmigen Stoffe gemischt, so entsteht ein zündfähiges Gasgemisch. Jetzt wird auch klar, warum in Batterieladeräumen der Umgang mit offenem Feuer verboten ist.
Der bei einer Überladung des Bleiakkus aufgetretene Wasserverlust muß dann entsprechend mit nichtleitendem, also entmineralisiertem Wasser aufgefüllt werden. Bei sogenannten wartungsfreien Batterien wird durch Rekombinationselektroden und einen geschlossenen Aufbau dafür gesorgt, daß sich das Knallgas ohne den bewußten Knall wieder zu Wasser verwandelt. Aber Vorsicht, werden wartungsfreie Batterien mit mehr als 2,35 V geladen, entsteht soviel Knallgas, daß diese Elektroden nicht mehr mitkommen und das Sicherheitsventil anspricht - und dann ist durch den Wasserverlust die Kapazität der Batterie für immer herabgesetzt.
Zur Information: Es gibt laut DIN 40729 vier Spielarten von "dichten" Batterien bzw. Zellen. Die geschlossene Zelle besitzt Öffnungen, durch welche entstehende Gase entweichen und Wasser nachgefüllt werden kann. Diese Öffnungen sind gemeinhin mit einem eingeschraubten Stopfen verschlossen, so wie man es von herkömmlichen Autobatterien kennt.
Verschlossene Zellen sind flüssigkeitsdicht verschlossen und verfügen gegebenenfalls über ein Ventil, das eventuell auftretenden Überdruck entweichen lassen kann, und sind wartungsfrei. Im Gegensatz zu den geschlossenen Zellen darf man eine verschlossene Zelle auch schon einmal auf den Kopf stellen, ohne daß Elektrolyt ausläuft.
Die gasdichten Zellen sind, wie der Name schon sagt, gasdicht versiegelte Zellen, die allenfalls über ein Sicherheitsventil verfügen. Dieses Sicherheitsventil ist meist so konstruiert, daß es nach einem eventuellen Ansprechen wieder gasdicht schließt. Gasdichte Zellen sind lageunabhängig zu betreiben und wartungsfrei.
Eine hermetisch dichte Zelle ist völlig von einem gasundurchlässigen Mantel umkleidet. Meist ist ihr Innenaufbau derart gestaltet, daß sich zu Sicherheitszwecken ein spezieller Hohlraum eingebaut ist, der bis zu einem gewissen Maße eventuell entstehendes Gas aufnehmen kann, ohne daß die Zelle explodiert. Die Dichtigkeit einer hermetisch dichten Zelle wird akademisch durch eine zulässige Heliumleckrate definiert.
Die Pflege und Hege von Bleiakkus
Vorhin war schon einmal kurz die Rede von ihm, dem Bleischlamm. Er ist für das Ende fast aller Bleiakkus verantwortlich, auch ein Maß für die Plattenabnutzung, und entsteht hauptsächlich während der Ladephase, besonders aber bei Überschreitung der Ladeendspannung. Die auch bei der Normalladung, allerdings in weitaus geringerem Umfang, entststehenden kleinen Gasbläschen reißen feine Masseteilchen mit sich, die als Schlamm zu Boden sinken. Der Schlamm ist leitfähig.
Normalerweise hat der Batteriehersteller für diesen Schlamm spezielle Auffangräume vorgesehen. Erreicht jedoch der Schlamm die Elektroden, so kommt es zur Brückenbildung. Meist ist davon zunächst nur eine Zelle betroffen, was sich bei defekten Autobatterien leicht nachmessen läßt. Fazit: Das Gasen eines Bleiakkus deutet auf eine base Mißhandlung und sollte vermieden werden. Zusätzlich kann dabei das Blei sintern und dadurch die Plattenkapazität sinken. Außerdem wird durch zu starke Ladung der Elektrolyt erwärmt, so daß sich sogar das Blei wieder in Bleisulfat verwandeln kann, also der Entladevorgang schon chemisch vorweggenommen wird. Übrigens: Es ist ein Märchen, daß ein Bleiakku stets vollgeladen werden muß, um nicht frühzeitig zu altern.
Noch ein Wort zum Thema Schnelladung bei Bleiakkus. Diese muß nicht unbedingt "ungesünder" als die Normalladung sein. Wichtig ist, daß die Ladeendspannung nicht überschritten wird und vor allem die Elektrolyttemperatur keinesfalls über 55 Grad Celsius steigt. Bei kritischen Anwendungen, beispielsweise im Raumfahrtbereich, überwachen Temperaturfühler den Ladevorgang und erlauben sogenanntes TGL (temperaturgeführtes laden).
Bei tiefen Temperaturen, also unter dem Nullpunkt, lassen sich Bleiakkus nur noch schwer laden, bei minus zehn Grad überhaupt nicht mehr. Es lohnt sich also durchaus, die Autobatterie im Winter thermisch zu isolieren.
Bleiakkus sollten stets voll geladen gelagert werden (das ist bei anderen Sekundärbatterien nicht immer der Fall!). Wer viel Zeit zur Pflege hat, der sollte alle 14 Tage eine zweistündige Ladung zum Ausgleich der Selbstentladung durchführen und spätestens alle zwei Monate eine kompletten Entlade/Lade-Zyklus durchführen. Einfacher ist es, eine Erhaltungsladung durchzuführen. Hierzu kann ohne weiteres eine strombegrenzte Konstantspannungsquelle von 2,3 V dienen.
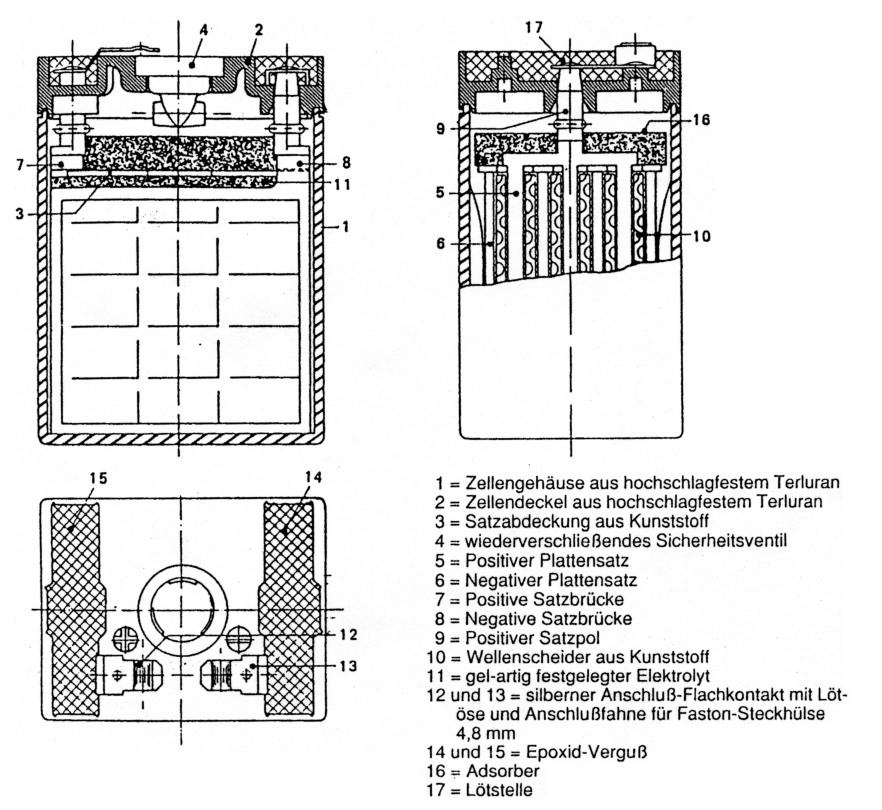
Abb. 2: Aufbau einer Zelle mit gelförmigen Elektrolyt.
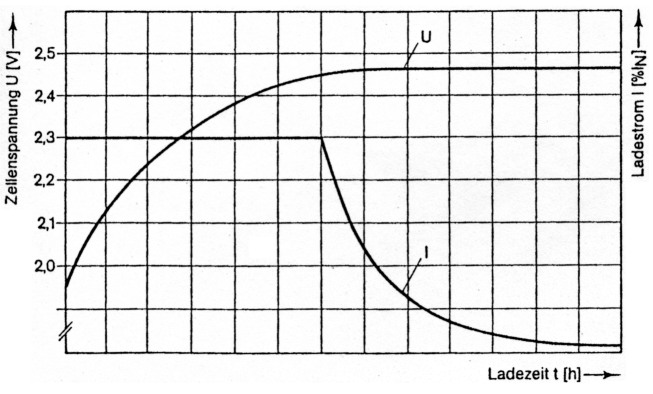
Abb. 3: Typischer Verlauf der Spannungs- und Stromkennlinien bei der Ladung einer Blei/Bleioxid-Zelle. Die Ladeendspannung ist hier ungewöhnlich hoch angesetzt. Als optimale Ladespannung wird für die meisten Typen 2,35 V pro Zelle angesehen.
Bleigelakkus arbeiten lageunabhängig
Eine ganz gescheite Sache sind die Bleigelakkus: Sie arbeiten weitgehend lageunabhängig, sind wartungsfrei, gasdicht, in diversen Bauformen erhältlich und gestatten die Entnahme relativ hoher Ströme. Der Elektrolyt besteht hier aus Schwefelsäure mit einem Schuß Phosphorsäure. Das Ganze ist in einem speziellen Gel gebunden, welches Si02 enthält. Allerdings muß man bei ihnen aufpassen, daß man auf keinen Fall die Ladespannung von 2,3 V pro Zelle überschreitet, sonst nehmen sie bleibenden Schaden. Die Entladeschlußspannung darf 1,75 V pro Zelle nicht unterschreiten. Eine Bleigelbatterie übersteht mehr als 200 Entlade/Lade-Zyklen bei voller Leistungsentnahme. Bei kleinen Strömen oder Abbruch der Entladung vor völliger Entleerung kann sich dieser Wert verdoppeln oder vervielfachen. Nebenbei: Scheinbar völlig defekte, hochohmige Bleigelakkus lassen sich oft wieder für den Amateurfunk nutzbar machen. Eine Ladung mit 1 mA Strombegrenzung über mehrere Wochen hinweg hat schon manchen Bleigelakku wieder zu neuem Leben erweckt, dabei sinkt die Klemmenspannung allmählich von einem Vielfachen der Nennspannung auf diese ab.
Nach zwei bis drei Entlade/Ladezyklen stehen dann nach eigenen Erfahrungen oft noch zwei Drittel der Nennkapazität zur Verfügung. Mißhandelte Bleigelakkus haben oft Wasser verloren. Der geschickte Bastler kann die Dichtungspfropfen entfernen und das in Form von Sauerstoff und Wasserstoff entwichene Wasser wieder ergänzen. Allerdings ist eine geöffnete Batterie dieser Bauart nicht immer wieder völlig dicht zu bekommen, weshalb von solchen Maßnahmen abgeraten werden muß.
Weil eine Bleigelbatterie hermetisch gegen Luftzutritt abgeschlossen ist, kann sie voll geladen ohne weiteres ein bis zwei Jahre bei Zimmertemperatur gelagert werden, bei gelegentlicher Nachladung wesentlich länger. Würde man die Bleigelbatterie im Kühlschrank bei 8 Grad aufbewahren, könnte sich die Lagerzeit verdoppeln. Aber im Kühlschrank hat man sicher Besseres zu lagern...
Bleigelakkus sollten aber nie Temperaturen unter Null ausgesetzt werden, da sonst die im Elektrolyt auftretenden Eiskristalle die Poren sprengen.
Teil 1 - Teil 2.
DK1WC, Wolf P. Tangermann.