Koolstof



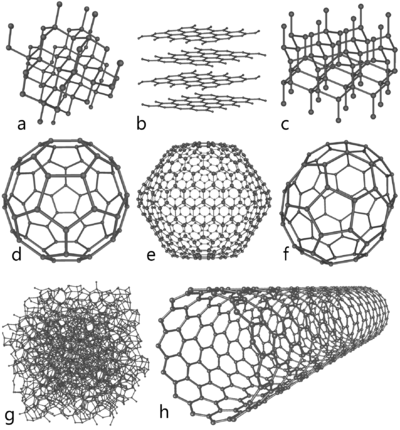
Allotrope vormen van koolstof: a) diamant, b) grafiet, c) Lonsdaleïet, d) fullereen (C60), e) C540, f) C70, g) amorf, h) nanobuis
Afkorting: C
Koolstof is niet-metaal dat in verschillende modificaties voorkomt. Eén daarvan is een kleurloze halfgeleider, een andere een zwart halfmetaal.
Koolstof is een vierwaardig element dat in grote hoeveelheden op aarde voorkomt. Koolstof kent vier allotrope vormen:
- diamant, het hardste natuurlijke mineraal dat we kennen, met een hardheid van 10,0;
- grafiet, een van de zachtste bekende substanties, met een hardheid van 1,5, maar in de vorm van koolstofvezel wel met een hoge treksterkte;
- fullereen, welke structurele en elektrochemische eigenschappen heeft waarmee het potentieel bruikbaar is voor nanotechnologie;
- amorf.
Nucleaire eigenschappen
Atoomnummer: 6
| Schil | Aantal electronen |
|---|---|
| 1 | 2 |
| 2 | 2, 2 |
Isotopen
| Atoom- gewicht |
Vervaltijd | Verval- vorm |
Vervalproduct |
|---|---|---|---|
| 11 | 20,39 minuten | Electronen vangst | 11B |
| 12 | Stabiel | ||
| 13 | Stabiel | ||
| 14 | 5730 jaar | β | 11N |
Het radioactief isotoop 14C (Koolstof 14) wordt in de atmosfeer voortdurend aangemaakt door kernreacties ten gevolge van de kosmische straling. Koolstof-14-datering wordt veel gebruikt om archeologische vondsten te dateren.
Fysische eigenschappen
Sublimatiepunt: ±3920 K
Dichtheid bij 293 K en 1000 hPA: 2620 kg/m3.
Biologische eigenschappen
Toxicologie en veiligheid
Koolstof wordt (beperkt) gebruikt als voedseladditief. In de EU is dit toegestaan onder E-nummer E153. Ook als medicijn als actieve koolstof (Norit®).
Roetuitstoot door onder andere het verkeer bestaat voor een belangrijk deel uit koolstof. Koolstof is daarmee een component van fijn stof.
Naast de talloze koolstofverbindingen zonder welke het leven op aarde niet mogelijk zou zijn, zijn er ook veel toxische koolstofverbindingen, waaronder:
- koolstofmonoxide (CO) dat onder andere voorkomt in uitlaatgassen van verbrandingsmotoren;
- het cyanide-ion (CN-), dat soms in mijnen wordt aangetroffen, maar ook een belangrijke toepassing heeft bij de productie van polymeren als polyurethaan.
Organische gassen zoals ethyleen (CH2=CH2) en methaan (CH4) zijn explosief en brandbaar wanneer ze met lucht (zuurstof) gemengd zijn.
Vrijwel alle niet-ionaire koolstofverbindingen zijn in meer of mindere mate brandbaar.
Bronnen
Er zijn als gezegd zo'n 10 miljoen koolstofverbindingen bekend. Koolstof komt in grote hoeveelheden voor in sterren (en dus de zon), kometen en in de atmosfeer van veel planeten. Sommige meteorieten bevatten microscopisch kleine diamanten die gevormd zijn toen ons zonnestelsel nog een protoplanetaire schijf was. Koolstof komt in diverse verbindingen voor in de aardatmosfeer en in water. Koolstofdioxide CO2 is daarvan wellicht de voornaamste verbinding.
Een zeer geleidelijke door mensen veroorzaakte toename van CO2 in de atmosfeer wordt door velen gezien als een bedreiging voor de aarde. Men spreekt van het versterkt broeikaseffect.
In combinatie met kleinere hoeveelheden calcium, magnesium en ijzer komt koolstof op aarde in grote hoeveelheden voor in carbonaat en rotsgesteenten als kalksteen, dolomiet, marmer, etc. Koolstof komt ook in zeer grote hoeveelheden voor in fossiele brandstoffen. Grafiet wordt in grote hoeveelheden aangetroffen in de Verenigde Staten, Rusland, Mexico, Groenland en India.
Natuurlijke diamanten worden gevonden in oude vulkanische gesteenten, opgesloten in het mineraal kimberliet. De meeste diamanten worden gedolven in Afrika, vooral in Zuid-Afrika, Namibië, Botswana, de Republiek Congo en Sierra Leone. Verder worden diamanten gevonden in Canada, de Russische Poolzee, Brazilië en in Noord- en West-Australië.
Grafeen

Grafeen is een enkellaagsvlak van koolstofatomen. Het kan voorgesteld worden als een vlak bijenraat of kippengaas met de dikte van één atoom. Grafiet kan gezien worden als een opeenstapeling van lagen grafeen. De koolstofatomen in grafeen zijn alle sp2-gehybridiseerd. Grafeen is 200 keer meer bestand tegen breken dan staal, wat maakt dat het één van de sterkste materialen is die momenteel bekend zijn. Grafeen is ook één van de snelste halfgeleiders (zo'n honderd keer sneller dan silicium). Momenteel doen hardwarefabrikanten reeds onderzoek naar transistoren uit grafeen.
Als grafeen met waterstofgas reageert, ontstaat grafaan. Bij volledige verzadiging met waterstof zijn alle koolstofatomen dan sp3-gehybridiseerd.