Atomen
Een atoom is van ieder scheikundig element de kleinste nog als zodanig herkenbare bouwsteen. Er bestaan echter nog kleinere elementaire deeltjes waar de atomen weer uit bestaan, bijvoorbeeld quarks.
Vrijwel alle scheikundige en natuurkundige eigenschappen van de op aarde voorkomende materie zijn gekoppeld aan de eigenschappen van atomen. Het is daarom een sleutelbegrip in deze beide wetenschappen. De eigenschappen van atomen als geheel worden bestudeerd in de atoomfysica.
In bijvoorbeeld sterren, neutronensterren en zwarte gaten komt echter ook materie voor die niet uit atomen is opgebouwd. De studie van deze, vanuit aards perspectief bijzondere vormen van materie is het terrein van de plasmafysica en de astrofysica.
Componenten van het atoom
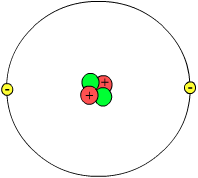
Een atoom bestaat uit een uiterst kleine, positief geladen atoomkern die is opgebouwd uit protonen (rood in de tekening met een positieve lading) en neutronen (groen in de tekening zonder ladening) met daaromheen een wolk van negatief geladen elektronen (geel in de tekening). De elektronenwolk blijft rondom de kern zitten door de elektrische aantrekking tussen de positief geladen kern en de negatief geladen elektronen, kernbinding genoemd. Een sterk vereenvoudigd model van een atoom (het zogenaamde planeetmodel van Hantaro Nagaoka) wordt weergegeven in de bovenstaande illustratie.
De studie van de atoomkernen is het terrein van de kernfysica. Het is mogelijk de bouwstenen van de kern nog verder te splijten in nog kleinere subatomaire deeltjes. Dit is het terrein van de hoge-energiefysica.
De kern
Veel natuurkundige eigenschappen (bijvoorbeeld de massa of het radioactief gedrag van het atoom) hebben niets met de elektronen te maken, daar speelt juist de atoomkern met zijn protonen en neutronen een grote rol.
De kern is bijzonder klein: de diameter ligt tussen 1,6 en 15 femtometer, dat is ongeveer 20 000 keer zo klein als het atoom. Doordat elektronen in vergelijking met protonen en neutronen vrijwel geen massa hebben, bevindt vrijwel alle massa van een atoom zich in deze piepkleine kern. De protonen en neutronen worden bij elkaar gehouden door de sterke kernkracht. Het aantal protonen wordt het atoomnummer genoemd. Het bepaalt de chemische eigenschappen van het atoom. Het aantal neutronen is bijna altijd groter dan het aantal protonen. Atomen met een gelijk aantal protonen kunnen als gevolg van een verschillend aantal neutronen verschillen in massa. Ze worden isotopen genoemd. Deze isotopen zijn chemisch identiek, maar hun fysische eigenschappen kunnen verschillen.
Proton
Een proton (voorgesteld door p, p+ of N+) is een subatomair deeltje met een positieve elektrische lading. Ernest Rutherford ontdekte het in 1919. De atoomkern (of nucleus) van het meest voorkomende type (zie ook isotoop) waterstofatoom, H, is één enkel proton. De nuclei van andere atomen bevatten zowel neutronen als protonen. Het aantal protonen van de kern bepaalt tot welk chemisch element het atoom behoort.
Bij afspraak noemt men de lading van één proton de eenheid van lading. De lading van een elektron is exact tegengesteld aan die van een proton, daar het elektron negatief geladen is. In een neutraal atoom is het aantal protonen in de kern gelijk aan het aantal elektronen in de 'schil(len)' eromheen. In deze situatie heffen de positieve ladingen van de protonen en de negatieve ladingen van de elektronen elkaar naar buiten op. Het atoom is dan van buiten af gezien elektrisch neutraal.
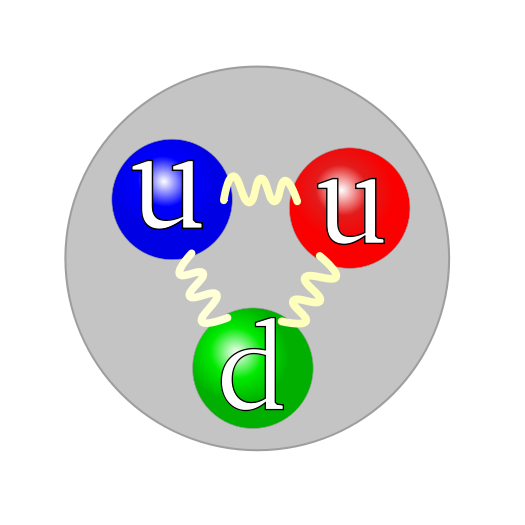
Quark structure proton
Een proton heeft een rustmassa van 1,672 623 1 × 10-27 kg of 938 MeV, hetgeen iets minder is dan de massa van een neutron. Daarmee is het ongeveer 1800 keer zo zwaar als een elektron. De lading van een proton is gelijk aan 1,6 × 10-19 C.
Protonen worden geclassificeerd als baryonen en bestaan op hun beurt weer uit quarks, namelijk twee 'up' quarks en een 'down' quark. Deze quarks worden bij elkaar gehouden door gluonen, de dragers van de sterke kernkracht.
Ook protonen en neutronen worden binnen een atoomkern bij elkaar gehouden door de sterke kernkracht, een kracht die alleen een merkbare rol speelt op subatomaire schaal (dus binnen de kern), maar die dan zo sterk is dat deze de onderlinge elektrische afstoting tussen de protonen overwint.
Aangezien de elektromagnetische kracht vele malen sterker is dan de zwaartekracht, moet men concluderen dat het aantal protonen in het universum gelijk is aan het aantal elektronen. Was dat niet het geval, dan zou de nettoafstoting door het overschot aan positieve of negatieve lading (afhankelijk of protonen of elektronen zouden domineren) een merkbaar effect hebben op de e×pansie van het universum en op alle materie onder de invloed van zwaartekracht (planeten, sterren, en dergelijke).
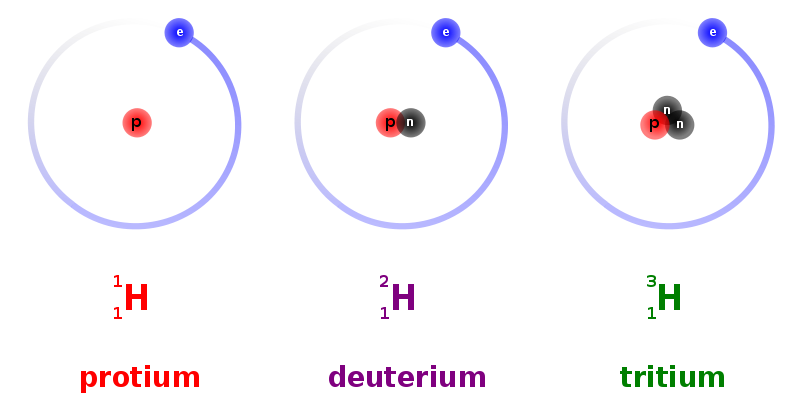
Het blijkt dat 99,985 % van de waterstofionen (H+) bestaan uit protonen. De andere 0,015 % zijn deuteronen een minieme hoeveelheid tritonen. In de natuur komen de tritionen (3H) niet voor, deze kunnen alleen kunstmatig aangemaakt worden.
Een zuur is een chemische stof die een waterstofion H+ kan afstaan. In waterig milieu gaat dit los proton bijna altijd een verbinding aan met water door een hydroxoniumion (H3O+) te vormen.
Neutron
Een neutron is een subatomair deeltje zonder elektrische lading dat voorkomt in atoomkernen. Het is opgebouwd uit 2 down-quarks en 1 up-quark. Alle atoomkernen op één na bevatten naast een of meer protonen ook een of meer neutronen. De enige uitzondering is 1H (de meest voorkomende vorm van waterstof), waarvan de kern uit alleen één proton bestaat. De massa van het neutron is vrijwel gelijk aan die van het proton (het neutron is iets zwaarder), maar het neutron mist de positieve lading van het proton.
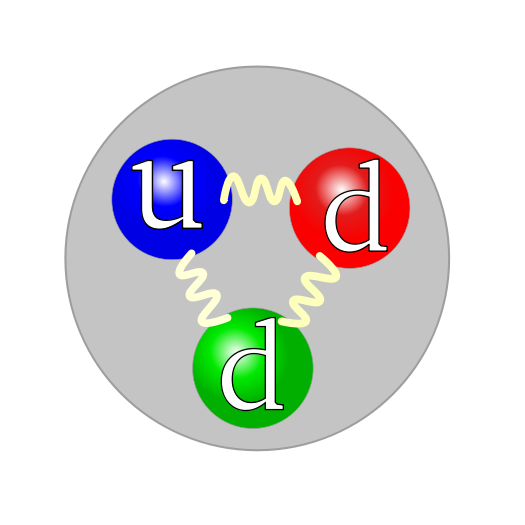
Quark structure neutron
De rustmassa van een neutron is 1,00894 atomaire massa-eenheid (a.e.), dat is 1,67493 × 10-27 kg. Het deeltje kan vrijkomen bij kernsplitsing, bijvoorbeeld in kernreactoren en bij de e×plosie van een atoombom, maar het is in deze vrije toestand (dus buiten de atoomkern) niet stabiel. De vervaltijd (aangeduid met τ) is 14:46 minuten. Het vervalt tot een elektron, een proton en een elektron-antineutrino. Dit is een voorbeeld van β-verval (elektronenemissie wordt bètastraling genoemd). Vrijwel alle massa wordt daarbij doorgegeven aan het proton.
De elektronenwolk
De grootte van een atoom wordt bepaald door de elektronenwolk. Afhankelijk van het atoomnummer varieert de straal van een atoom van circa 60 (helium) tot 275 (francium) pm. Sinds begin jaren 80 is dat groot genoeg om met behulp van atomic force microscopie (AFM) en scanning tunneling microscopie (STM) te visualiseren.
De elektronenwolk wordt het best beschreven als een kansverdeling, waarbij een elektron zich niet op een e×act bepaalde plaats bevindt. Men kan slechts spreken van een bepaalde kans een elektron binnen een eindig volume aan te treffen. Elk elektron van het atoom heeft een andere kansverdeling, hetgeen beschreven wordt met de kwantummechanica. Deze kansverdelingen worden vaak "schillen" genoemd (de juiste naam voor de omgeving waarin het elektron zich kan bevinden is "orbitaal"), omdat de elektronen met de hoogste energie zich over het algemeen verder van de kern, in de "buitenste schil", zullen bevinden.
De elektronen in de "buitenste schil" bepalen vooral de scheikundige eigenschappen van de atomen. Sommige natuurkundige eigenschappen (bijvoorbeeld de geleiding van een stof) worden ook door de buitenelektronen bepaald. Andere natuurkundige eigenschappen hebben echter meer met de binnenelektronen te maken, zoals het opwekken van röntgenstraling.
Verdeling elektronen
Er bestaan 8 elektronenschillen en deze worden aangeduid met opeenvolgende letters. Elke schil is onderverdeeld in verschillende sub-schillen, die naar gelang de toename van het aantal elektronen in deze volgorde worden gevuld. De subschillen worden aangegeven door een letter uit de reeks s(harp), p(rincipal), d(iffuse), f(undamental), g, h, i, j, k, ... (de termen komen van de atoomspectra). Dit geheel wordt meestal verduidelijkt met een tabelletje
| Subschillen | s | p | d | f | g |
|---|---|---|---|---|---|
| Elektronen | 2 (2*1) | 6 (2*3) | 10 (2*5) | 14 (2*7) | 18 (2*9) |
| Schillen | |||||
| K | 1s | ||||
| L | 2s | 2p | |||
| M | 3s | 3p | 3d | ||
| N | 4s | 4p | 4d | 4f | |
| O | 5s | 5p | 5d | 5f | 5g |
| P | 6s | 6p | 6d | 6f | 6g |
| Q | 7s | 7p | 7d | 7f | 7g |
Elementen
Atomen kunnen onderscheiden worden naar het aantal protonen in de kern. Dit aantal heet het atoomnummer. Een stof die bestaat uit atomen met hetzelfde atoomnummer heet een element. Er zijn anno 2006 meer dan 118 verschillende elementen bekend, waarvan een aantal echter niet op aarde voorkomt. De elementen worden gerangschikt in het periodiek systeem.
Isotopen
Atomen die tot een zelfde element behoren kunnen wel een verschillend aantal neutronen hebben. Men spreek dan van isotopen. De naam isotoop komt van het Griekse iso = gelijk en topos = plaats, hiermee wordt bedoeld dat isotopen dezelfde plaats in het periodiek systeem innemen. Isotopen hebben dezelfde chemische maar andere fysische eigenschappen. Van vrijwel alle elementen is meer dan één isotoop bekend. Daarnaast is het mogelijk om met behulp van kernsplijting en kernfusie nieuwe atomen te produceren, maar deze zijn vaak instabiel en ondergaan radioactief verval. Daarnaast wordt de term allotroop gehanteerd. Hiermee wordt bedoeld dat atomen die tot één element behoren in clusters kunnen voorkomen, die uit een verschillend aantal atomen bestaan.
Ionen
De elektromagnetische kracht houdt de elektronen rondom de kern. Bij een neutraal atoom is het aantal protonen gelijk aan het aantal elektronen. Wanneer een atoom een verschillend aantal protonen en elektronen bevat, en dus niet neutraal is, spreekt men van een ion. Ionen met een tekort aan elektronen worden kationen genoemd; ionen met overschot aan elektronen anionen.
Een ion is in principe instabiel als het los voorkomt; het zal proberen een elektron uit de omgeving aan te trekken, of een elektron proberen los te laten. Ionen met gelijke lading stoten elkaar af. Met tegengestelde lading trekken zij elkaar aan. Men treft daarom altijd tegengestelde ionen bij elkaar in de buurt zodat gemiddeld gesproken de materie weer neutraal is (wet van behoud van lading).
Ionen kunnen bij hoge temperaturen gevormd worden in een gas, men spreekt dan van een plasma. Bij lagere temperaturen worden ionen ook in oplossingen aangetroffen. Ionen van tegengestelde lading kunnen ook uit oplossing neerslaan en een vaste stof vormen die men uit ionen opgebouwd kan beschouwen. Deze stoffen noemt men zouten.
Moleculen
Er zijn gassen die uit losse atomen bestaan, dit zijn voornamelijk de edelgassen, zoals argon, maar het geldt ook voor de damp van bijvoorbeeld kwik. Meerdere atomen kunnen zich echter ook organiseren in moleculen en veel gassen en dampen bestaan uit losse moleculen. Waterstof moleculen zijn opgebouwd uit twee waterstofatomen.